integrantes :
elisa lloverá # 08
yuderkis rodriguez #26
4º D
TEMA: GASES NOBLES
lunes, 21 de mayo de 2012
gases nobles
Por que se clasifican los gases nobles
los gases nobles se clasifican en el grupo cero porque su valencia es cero, esto debido a que su ultima capa de electrones (conocida como capa de valencia) contiene los 8 electrones necesarios para llegar a la estabilidad, por lo que es muy difícil que reaccionen estos gases.
y se le llama así debido a la valencia 0 de estos elementos ya que como su ultima capa esta completa no tienen electrones de valencia.
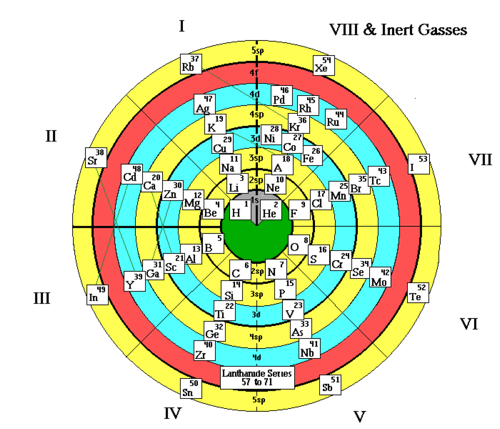
los gases nobles se clasifican en el grupo cero porque su valencia es cero, esto debido a que su ultima capa de electrones (conocida como capa de valencia) contiene los 8 electrones necesarios para llegar a la estabilidad, por lo que es muy difícil que reaccionen estos gases.
y se le llama así debido a la valencia 0 de estos elementos ya que como su ultima capa esta completa no tienen electrones de valencia.

gases nobles

características de los gases nobles
Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su coraza electrónica de electrones valentes se la considera completa, dándoles poca tendencia a participar en reacciones químicas y solo unos pocos compuestos de gases nobles han sido preparados hasta 2008.
El punto de fusión y el de ebullición de cada gas noble están muy próximos, difiriendo en menos de 10 ºC; consecuentemente, sólo son líquidos en un rango muy pequeño de temperatura.
El xenón reacciona espontáneamente con el flúor y a partir de los compuestos resultantes se han alcanzado otros. También se han aislado algunos compuestos con kriptón.
Las características de los gases nobles como grupo es la de ser "inertes". Debido a su poca densidad y su carácter de no inflamable, por ejemplo: El hielo se utiliza para llenar proceso metalúrgicos para impedir que los materiales reaccionen con el oxigeno y el nitrógeno en el aire. Los gases nobles pertenecen al grupo VIIIA en la tabla periódica se comprende de Hielo, Neón, Argón, Criptón, Xenón, Radón. Ten encuentra que los gases nobles existen como átomos gaseosos individuales, es decir que no tienden a participar en reacciones con otros elementos.
Trate de hacerlo corto y preciso para tu entendimiento la fuente de donde lo tome fue de un Libro de texto espero que te sirva
Los gases nobles cuentan con fuerzas intermoleculares muy débiles y, por lo tanto, tienen puntos de fusión y ebullición muy bajos. Todos ellos son gases monoatómicos bajo condiciones estándar, incluso aquellos elementos que tienen masas atómicas mayores que elementos que se encuentran normalmente en estado sólido. El helio tiene varias propiedades únicas con respecto a otros elementos: tanto su punto de ebullición como el de fusión son menores que los de cualquier otra sustancia conocida; es el único elemento conocido que exhibe superfluidez; es el único elemento que no puede ser solidificado por enfriamiento bajo condiciones estándar, sino que se convierte en sólido bajo una presión de 25 atm (2500 kPa; 370 psi) y 0.95 K (-272.200 °C; -457.960 °F).22 Los gases nobles hasta el xenón tienen múltiples isótopos estables. El radón no tiene isótopos estables; su isótopo de mayor duración tiene una periodo de semidesintegración de 3.8 días y decae a formar helio y polonio y este último, a su vez, decae a plomo.
Los gases nobles se comportan casi como gases ideales bajo condiciones estándares, pero sus desviaciones a la ley de los gases ideales entregan claves importantes para el estudio de las interacciones moleculares. El potencial de Lennard-Jones, usado frecuentemente para modelar fuerzas intermoleculares, fue deducido en 1924 por John Lennard-Jones a partir de datos experimentales del argón antes de que el desarrollo de la mecánica cuántica entregara las herramientas necesarias para entender las fuerzas intermoleculares a partir de primeros principios.25 El análisis teórico de estas fuerzas se volvió tratable debido a que los gases nobles son monoatómicos con átomos esféricos, lo que significa que la interacción entre átomos es independiente de la dirección, es decir, es isótropa .
gases nobles
Nuevos científicos de los gases nobles o gases inertes
| Helio: He |
| Descubridor : Joseph Norman Lockyer(Inglés) y Pierre Jules César Jannsen (Francés) |
| Año : 1868 |
| Etimología : del griego helios (sol) |
- Inodoro, incoloro e insípido.
- El nombre es una consecuencia de haberse descubierto en la atmósfera solar antes que en la Tierra.
- William Ramsay descubrió en 1895 la presencia de helio en la Tierra al analizar un mineral de uranio. El helio terrestre es una consecuencia de procesos radiactivos.
|
- A temperaturas muy bajas, inferiores a 2,17 K(-271,02 ºC) , el helio essuperfluido (su viscosidad desaparece) y superconductor.
- Si hablamos después de haber respirado el helio de un globo tendremos una voz muy aguda parecida a la del pato Donald. El helio tan ligero (solo el hidrógeno lo es menos) que las cuerdas vocales vibran mucho más fácilmente que en el aire
| Neón: Ne |
| Descubridor : William Ramsay(1852-1916) y Morris W. Travers (Ingleses) |
| Año : 1898 |
| Etimología : del griego neos (nuevo) |
- Inodoro, incoloro e insípido.
- Es prácticamente inerte.
- Lo descubrieron destilando argón líquido obtenido a partir del aire.
- Se obtiene a partir de la atmósfera terrestre que lo contiene en una concentración de dieciocho partes por millón en volumen.
|
| Argón: Ar |
| Descubridor : William Ramsay(1852-1916) y John William Strutt(1842-1919) (barón Lord Rayleygh) (Ingleses) |
| Año : 1894 |
| Etimología : del griego argon (inerte, inactivo) |
- Inodoro, incoloro e insípido. Es prácticamente inerte. SE obtiene de la atmósfera terrestre que lo contiene en un 0,94 % en volumen.
- En 1785 Cavendish comprobó que al separar el oxígeno y nitrógeno del aire quedaba una porción(1/120) del mismo que correspondía a una sustancia inerte. Su trabajo fue olvidado durante el siglo siguiente.
- Fue el primer gas noble descubierto en la Tierra. El helio se había descubierto en el Sol.
- Poco después de descubierto el argón, Lecoq de Boisbaudran predijo que pertenecía a una familia de elementos inertes cuyas masas atómicas anticipó.
- Se usa en la fabricación de bombillas, tubos fluorescentes y en muchas aplicaciones que requieren la presencia de un gas inerte.
| Criptón: Kr |
| Descubridor : William Ramsay(1852-1916) y Morris W. Travers (Ingleses) |
| Año : 1898 |
| Etimología : del griego kryptos (escondido) |
- Inodoro, incoloro e insípido. Se obtiene de la atmósfera terrestre que lo contiene en una parte por millón.
- Durante muchos años fue considerado inerte. En los años 60 del S. XX se prepararon algunos de sus compuestos, el primero de ellos fue eldifluoruro de criptón [KrF2]
- Entre sus usos se encuentra la fabricación de flases para fotografía de alta velocidad.
| Xenón: Xe |
| Descubridor : William Ramsay(1852-1916) y Morris W. Travers (Ingleses) |
| Año : 1898 |
| Etimología : del griego xenos (estranjero) |
- Inodoro, incoloro e insípido. Se obtiene de la atmósfera terrestre que lo contiene en una parte por diez millones.
- Fue el primer gas noble a partir del que se prepararon compuestos. El primero de ellos lo sintetizó en 1962 Neil Barlett: hexaflúorplatinato(V) de neón[Xe(PtF6)x, x = 1 o 2], un sólido cristalino rojo.
- Entre sus usos se encuentra la fabricación de flases para fotografía de alta velocidad.
| Radón : Rn | |
| Descubridor : Friedich Ernst Dorn(alemán) | |
| Año : 1900 | |
| Etimología : de radio (ver abajo) |
- Dorn demostró que uno de los productos de la descomposición del radio era un nuevo elemento. Inicialmente se le denominó emanación del radioo nitón, del latín nitens , brillante.
- En nombre radón se ha usado de forma restringida para denominar al isótopo radón-222. Al isótopo de masa 220 se le ha denominado torón (Tn) por proceder de la descomposición del torio y al de masa 219 actinón(An), por proceder del actinio. A la familia entera de isótopos se la conocía como emanacion (Em)
- A finales de la década 1980, se descubrió que el radón podía acumularse en ciertas casas poco ventiladas. Se filtra a través del suelo en ciertos terrenos , sobre todo aquellos que contienen minerales de uranio. La inhalación de radón puede provocar la aparición de cáncer de pulmón.
- Se conocen algunos compuestos de radón. En 1962 se consiguió sintetizar el primero : difluoruro de radón [RnF2].
gases nobles
Que tienen de noble los gases nobles
Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan «inertes». El nitrógeno y el platino son ejemplos de elementos inertes
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química. Estos nuevos gases —helio, neón, argón, criptón, xenón y radón— son más inertes que cualquier otro elemento y se agrupan bajo el nombre de «gases inertes».
Los elementos inertes reciben a veces el calificativo de «nobles» porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia. El oro y el platino son ejemplo de «metales nobles», y por la misma razón se llamaba a veces «gases nobles» a los gases inertes. Hasta 1962 el nombre más común era el de «gases inertes», quizá porque lo de nobles parecía poco apropiado en sociedades democráticas.
La razón de que los gases inertes sean inertes es que el conjunto de electrones de cada uno de sus átomos está distribuido en capas especialmente estables. La más exterior, en concreto, tiene ocho electrones. Así la distribución electrónica del neón es (2, 8) y la del argón (2, 8, 8). Como la adición o sustracción de electrones rompe esta distribución estable, no pueden producirse cambios electrónicos. Lo cual significa que no se pueden producir reacciones químicas y que esos elementos son inertes.

gases nobles
Usos
El helio se utiliza como componente de los gases respirables para sustituir al nitrógeno, gracias a su baja solubilidad en fluidos, especialmente en lípidos. Los gases son absorbidos por la sangre y los tejidos corporales cuando hay presión, como en elsubmarinismo, lo que provoca un efecto anestésico conocido como "mal de profundidad". Debido a su baja solubilidad, entra poco helio en las membranas celulares, y cuando se utiliza helio para sustituir parte de los gases respirables, como en el trimix o el heliox, se consigue una reducción del efecto narcótico del gas en profundidad. La baja solubilidad del helio ofrece más ventajas para el trastorno conocido como enfermedad por descompresión. A menor cantidad de gas disuelto en el cuerpo significa que se forman menos burbujas de gas durante la reducción de la presión durante el ascenso. Otro gas noble, el argón, es considerado la mejor opción como gas de inflación del traje seco en el submarinismo.Los gases nobles tienen un punto de ebullición y de fusión muy bajos, lo que los hace útiles como refrigerantescriogénicos.62 En particular, el helio líquido, que hierve a 4,2 K, se utiliza para imanes superconductores, como los que se emplean para la imagen por resonancia magnética y la resonancia magnética nuclear.63 El neón líquido, aunque no llega a temperaturas tan bajas como el helio líquido, también tiene aplicaciones en la criogenia, pues tiene una capacidad de refrigeración más de 40 veces superior a la del helio líquido y más de tres veces superior a la del hidrógeno líquido.60
Desde el desastre del Hindenburg de 1937,64 el helio ha sustituido al hidrógeno como gas de sustentación en los dirigibles y globos,64gracias a su ligereza e incombustibilidad, pese a una reducción en la flotabilidad de un 8,6%. En muchas aplicaciones, los gases nobles se utilizan para formar una atmósfera inerte. El argón se utiliza en la síntesis de compuestos sensibles al aire que al mismo tiempo, son sensibles al nitrógeno. El argón sólido también se utiliza para estudiar compuestos muy estables, como intermedios reactivos, atrapándolos en una matriz inerte a temperaturas muy bajas.65 El helio es utilizado como medio portador en lacromatografía de gases, como gas de relleno en los termómetros, y en aparatos para medir la radiación, como el contador Geiger y la cámara de burbujas. Tanto el helio como el argón se utilizan habitualmente para proteger arcos de soldadura y metal base que les rodea de la atmósfera durante la soldadura y la ablación, así como en otros procesos metalúrgicos y la producción de silicio para la industria de los semiconductores.60
Los gases nobles se usan habitualmente para la iluminación debido a su falta de reactividad química. El argón, mezclado con nitrógeno, se utiliza como gas de relleno de lasbombillas incandescentes.60 El kriptón se usa en bombillas de alto rendimiento, que tienen una temperatura de color más elevada y una mayor eficacia, pues reduce la velocidad de evaporación del filamento más que el argón, las lámparas de halógeno, en particular, utilizan kriptón mezclado con pequeñas cantidades de compuestos de yodo o bromo.60Los gases nobles lucen con colores característicos cuando se les utiliza en lámparas de descarga, como los faros de neón, que producen un color naranja-rojo. El xenón es utilizado habitualmente en faros de xenón que, debido a su espectro casi continuo que se asemeja a la luz del día, se usan en proyectores de películas y como faros de automóvil.60
Los gases nobles se usan en láseres de excímeros, que se basan en moléculas excitadas electrónicamente de vida corta conocidas como excímeros. Los excímeros utilizados en los láseres pueden ser dímeros de gases nobles como Ar 2, Kr 2 o Xe 2, o más habitualmente, el gas noble es combinado con un halógeno en excímeros como ArF, KrF, XeF o XeCl. Estos láseres producen una luz ultravioleta que, debido a su longitud de onda corta (193 nm por ArF y 248 nm para KrF), permite una imagen de alta precisión. Los láseres de excímeros tienen muchos usos industriales, médicos y científicos. Se utilizan en la microlitografía y la microfabricación, esenciales para la manufactura de circuitos integradosy por cirugía láser, incluyendo la angioplastia láser y la cirugía ocular.66 Algunos gases nobles tienen un uso directo en la medicina. A veces se usa el helio para mejorar la facilidad de respiración de los pacientes con asma.60 El xenón se utiliza como anestésico debido a su alta solubilidad en lípidos, que lo hace más potente que el habitual óxido nitroso, y como es eliminado fácilmente por el cuerpo, permite un restablecimiento más rápido.67 La captación de imágenes hechas a través de la resonancia magnética nuclearutiliza el xenón en combinación con otros gases. El radón, que es muy radiactivo y sólo está disponible en cantidad mínimas, sirve en el tratamiento por radioterapia.
- Colores producidos por los diferentes gases nobles en tubos de neón
gases nobles
Propiedades físicas y atómicas
| Propiedad | Gas noble | |||||
|---|---|---|---|---|---|---|
| Número atómico | 2 | 10 | 18 | 36 | 54 | 86 |
| Nombre del elemento | Helio | Neón | Argón | Kriptón | Xenón | Radón |
| Densidad (kg/m3) | 0,1785 | 0,9002 | 1,7818 | 3,708 | 5,851 | 9,970 |
| Radio atómico (nm) | 0,050 | 0,070 | 0,094 | 0,109 | 0,130 | — |
| Punto de ebullición (°C) | –268,83 | –245,92 | –185,81 | –151,70 | –106,60 | –62 |
| Punto de fusión (°C) | –272 | –248,52 | –189,6 | –157 | –111,5 | –71 |
Los gases nobles cuentan con fuerzas intermoleculares muy débiles y, por lo tanto, tienen puntos de fusión y de ebullición muy bajos. Todos ellos son gases monoatómicos bajo condiciones estándar, incluyendo aquellos que tienen masas atómicas mayores que algunos elementos que se encuentran normalmente en estado sólido. El helio tiene varias propiedades únicas con respecto a otros elementos: tanto su punto de ebullición como el de fusión son menores que los de cualquier otra sustancia conocida; es el único elemento conocido que presenta superfluidez; de la misma manera no puede ser solidificado por enfriamiento bajo condiciones estándar, sino que se convierte en sólido bajo una presión de 25 atm (2500 kPa; 370 psi) y 0,95 K (−272,20 °C; −457.960 °F).24 Los gases nobles hasta el xenón tienen múltiples isótopos estables. El radón no tiene isótopos estables; su isótopo de mayor duración tiene un periodo de semidesintegración de 3,8 días que puede formar helio y polonio.9
El radio atómico de los gases nobles aumenta de un periodo a otro debido al incremento en el número de electrones. El tamaño del átomo se relaciona con varias propiedades. Por ejemplo, el potencial de ionización disminuye a medida que aumenta el radio ya que los electrones de valencia en los átomos más grandes se encuentran más alejados del núcleo y, por lo tanto, no se encuentran ligados tan fuertemente por el átomo. Los gases nobles tienen los mayores potenciales de ionización de cada periodo, lo cual refleja lo estable que es su configuración electrónica y genera su falta de reactividad química.25 Sin embargo, algunos de los gases nobles más pesados tienen potenciales de ionización lo suficientemente bajos para ser comparables a los de otros elementos y moléculas. El químico Neil Bartlett, intentando crear el compuesto de un gas noble, notó que el potencial de ionización del xenón era similar al de la molécula de oxígeno, por lo que intentó oxidar xenón usando hexafluoruro de platino, un agente oxidante tan fuerte que es capaz de reaccionar con oxígeno.15 Los gases nobles no pueden aceptar un electrón para formar aniones estables. Esto quiere decir que poseen una afinidad electrónica negativa.

Gráfico de potencial de ionizaciónrespecto al número atómico. Los gases nobles tienen el mayor potencial de ionización de cada periodo.
Las propiedades físicas macroscópicas de los gases nobles están determinadas por las débiles fuerzas de Van der Waals que se dan entre átomos. Las fuerzas de atracción aumentan con el tamaño del átomo como un resultado del incremento en la polarizabilidad y el descenso del potencial de ionización. Esto lleva a tendencias grupales sistemáticas. Por ejemplo, a medida que se baja en los grupos de la tabla periódica, el radio atómico y las fuerzas interatómicas aumentan. De igual forma, se adquieren mayores puntos de fusión y deebullición, entalpía de vaporización y solubilidad. El aumento de densidad se debe al incremento en masa atómica.
Los gases nobles se comportan como gases ideales bajo condiciones normales de presión y temperatura, pero sus tendencias anormales a la ley de los gases ideales proporcionan claves importantes para el estudio de las fuerzas e interacciones moleculares. Elpotencial de Lennard-Jones, usado frecuentemente para modelar fuerzas intermoleculares, fue deducido en 1924 por John Lennard-Jonesa partir de datos experimentales del argón antes de que el desarrollo de la mecánica cuántica proporcionara las herramientas necesarias para entender las fuerzas intermoleculares a partir de primeros principios.27 El análisis teórico de estas fuerzas se volvió viable debido a que los gases nobles son monoatómicos, y por tanto isótropos (independientes de la dirección).
[editar]Propiedades químicas
| Z | Elemento | Electrones por capa |
|---|---|---|
| 2 | helio | 2 |
| 10 | neón | 2, 8 |
| 18 | argón | 2, 8, 8 |
| 36 | kriptón | 2, 8, 18, 8 |
| 54 | xenón | 2, 8, 18, 18, 8 |
| 86 | radón | 2, 8, 18, 32, 18, 8 |
En los seis primeros periodos de la tabla periódica, los gases nobles son exactamente los miembros del grupo 18 (8A) de la tabla (anteriormente conocido como grupo 0). Sin embargo, esto ya no es cierto en el séptimo periodo (debido a efectos relativistas): el siguiente miembro del grupo 18, el ununoctio, probablemente no es un gas noble.28 En cambio, el miembro del grupo 14 Ununquadio presenta propiedades similares a las de los gases nobles.29
Los gases nobles son incoloros, inodoros, insípidos y no inflamables en condiciones normales. Antiguamente se les asignaba el grupo 0 de la tabla periódica porque se creía que tenían una valencia cero, es decir, que sus átomos no se pueden combinar con otros elementos para formar compuestos. Sin embargo, más tarde se descubrió que algunos sí forman compuestos, haciendo que se abandonara esta denominación. Se conoce muy poco sobre las propiedades del miembro más reciente del grupo 18, el ununoctio (Uuo).30 Los gases nobles tienen capas llenas de electrones de valencia. Los electrones de valencia son los electrones que se encuentran más al exterior de los átomos y normalmente son los únicos que participan en los enlaces químicos. Los átomos con capas de valencia llenas de electrones son extremadamente estables y por tanto no tienden a formar enlaces químicos y tienen poca tendencia a ganar o perder electrones.31 Sin embargo, los gases nobles más pesados, como el radón, están unidos menos firmemente por la fuerza electromagnética que los más ligeros, como el helio, haciendo que sea más fácil retirar electrones exteriores de los gases nobles pesados. Debido a que dicha capa está completa, los gases nobles se pueden utilizar de acuerdo con la notación de configuración electrónica para dar lugar a una "notación de gases nobles". Para ello, primero se escribe el gas noble más cercano que precede al elemento en cuestión, y se continúa la configuración electrónica a partir de ese punto. Por ejemplo, la notación electrónica del carbono es 1s2 2s2 2p2, y su notación de gas noble es [He] 2s2 2p2. Esta notación hace que resulte más fácil identificar elementos, y es más corta que escribir toda la notación de orbitales atómicos.
Suscribirse a:
Entradas (Atom)








